- 发布人:xnxy120
- 时间:2022-12-21
- 来源:
- 浏览量:3221
本网讯(通讯员 高湘杰)近日,湘南学院附属医院谭东辉教授研究团队在《Advanced Science》(Q1 IF: 17.521)上发表题为“Encapsulation of Platinum Prodrugs into PC7A Polymeric Nanoparticles Combined with Immune Checkpoint Inhibitors for Therapeutically Enhanced Multimodal Chemotherapy and Immunotherapy by Activation of the STING Pathway”的研究论文。该论文首次报道了一种利用STING激动剂-PC7A高分子包裹肿瘤化疗药物四价铂前药制备而成的纳米粒子NP2,该纳米粒子可增强激活STING通路,增敏肿瘤化学免疫治疗及免疫检查点阻断治疗药物的效果。
STING(干扰素基因刺激因子)被证实在激活后可通过增强CD8+T细胞的活力,改善免疫抑制微环境,最终产生强效的抗肿瘤免疫应答。目前已知的经典STING通路为cGAS-STING通路,但该通路激活不仅依赖肿瘤细胞内异常DNA片段的数量,同时由于细胞内合成的cGAMP其稳定性和生物利用度较差,最终导致免疫刺激效果弱。为此,人们开发了一种多价强效STING激动剂—PC7A高分子,它可与STING表面位点非竞争性的结合,诱导STING-PC7A凝聚体的形成,激活依赖STING通路的抗肿瘤免疫应答。同时,PC7A具有pH响应性,可降低细胞内溶酶体对STING的降解,进而产生了长效的STING激活效果。然而, PC7A激活STING通路的效果易受PC7A中C7A单体单元含量的限制以及单独PC7A激活的STING信号通路引起的抗肿瘤免疫应答效果有限,这两者最终共同导致了PC7A引起的抗肿瘤免疫应答效果欠佳。
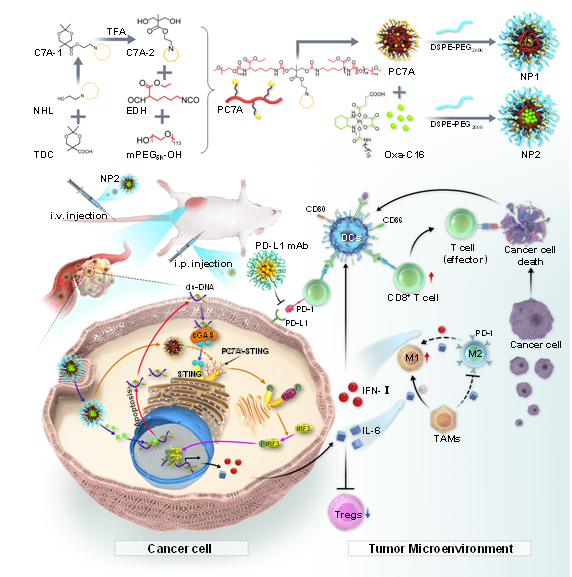
湘南学院附属医院谭东辉教授、中国科学院化学研究所肖海华研究员为该文的通讯作者。湘南学院附属医院耳鼻咽喉头颈外科高湘杰硕士、湘南学院附属医院临床医学研究中心雷冠雄博士为共同第一作者,湘南学院附属医院为论文第一完成单位。
原文链接https://onlinelibrary.wiley.com/doi/10.1002/advs.202205241


